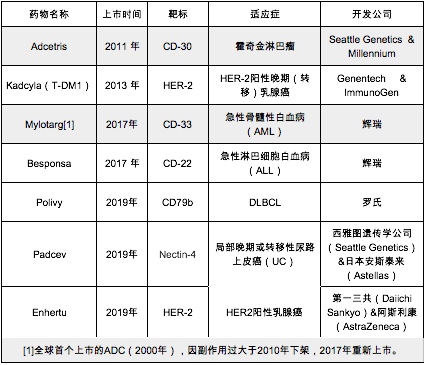
财联社(上海,记者 徐红)讯,2019年可以说是ADCs药物研制上市的重要一年,就在年底的最终一个月,就有两款ADC药物在一周内连续获批上市。
12月18日,西雅图学公司(Seattle Genetics)与日本安斯泰来(Astellas)联合宣告,FDA加快同意公司抗体药物偶联物(ADC)Padcev(enfortumab vedotin),用于医治部分晚期或转移性尿路上皮癌(UC,最常见的膀胱癌类型)患者。
12月21日,FDA又宣告,加快同意第一三共(Daiichi Sankyo)和阿斯利康(AstraZeneca)共同开发,靶向HER2的抗体偶联药物(ADC)Enhertu(fam-trastuzumab deruxtecan-nxki,曾用名DS-8201a)上市,医治无法切除或转移性HER2阳性乳腺癌患者。
加上本年6月罗氏靶向CD79b的ADC药物Polivy(曾经称为polatuzumab)获批上市,与利妥昔单抗和化疗苯达莫司汀联合运用,用于从前至少两次医治失利的或复发的弥漫性大B细胞淋巴瘤患者DLBCL,到现在,2019年一共上市了3款ADC药物,占到现在已上市7款ADC药物中的挨近一半。
紧跟国际形势,国内制药企业与研究机构在这两年也加大了对ADC药物的重视度。比方光大医药便在近期发布了关于ADC药物的深度陈述,而君实生物(01877.HK)也在12月初布告称,与杭州多禧生物科技有限公司签订了《药品拓荒和答应合同》,君实生物将从杭州多禧生物取得答应运用DAC-002,在授权答应区域(除日本、韩国之外的全数亚洲国度和区域)内担任DAC-002后续的临床实验、药品注册、交易化出产、发卖和其他交易。 DAC-002大多数都用在医治Trop2阳性三阴性乳腺癌、小细胞肺癌、胰腺癌等实体肿瘤,现在已向国家药品监督管理局申报临床试验并获受理。
关于近期FDA连续同意ADC药物上市的现象,业界以为一周内加快同意两款药物在FDA药物获批历史上都比较稀有。杭州多禧生物CEO赵永新博士一起猜测,下一年至少还有两款ADC药物可获批上市。
杭州多禧生物专心于ADC药物开发,公司股东还包含华海药业(600521.SH)和贝达药业(300558.SZ)。据了解,除了授权给君实生物的靶向Trop2的ADC以外,杭州多禧生物还有一款HER2-ADC已经在临床试验过程中。赵永新博士向记者泄漏,现在这款药物在复旦大学肿瘤医院的临床试验成果适当不错,“期望下一年发布成果时打败或不亚于DS-8201a”。
自阿斯利康与第一三共在本年3月达到69亿美元的研制协作以来,Enhertu也便是DS-8201a就一直是业界重视的方针。从提出申请到获批上市,Enhertu只花了两个月时刻,背面的原因便是该款药物的临床数据非常好。而第一三共也表明,这款立异ADC将是该公司近期药物开发的重中之重,将进行掩盖多个癌种的多项临床试验,阿斯利康和第一三共的宏伟方针是用它来革新HER2阳性肿瘤的医治。
繁荣的ADC药物研制热潮也带动了相关工业的开展。2018年6月,药明康德旗下大分子生物药外包服务渠道药明生物(02269.HK)便宣告称,将出资2000万美元在无锡建造第三个生物制剂出产基地(Drug Product 3, DP3),旨在为国内外协作伙伴供给包含ADCs在内的生物偶联药物(Biologics-Drug Conjugates)一体化研制出产服务。
在日前举办的一场沟通会上,药明生物表明,在公司渠道上,ADC和双抗项目的增长势头较快,增速明显高于传统的单抗药品。现在公司正在开发中的ADC药物有约25个,其间约10个处于临床开发阶段。

 美国Fit.Q品牌生酮碳水麸质阻断饮登陆中国新闻发布会
美国Fit.Q品牌生酮碳水麸质阻断饮登陆中国新闻发布会 冻龄颜值21天“吃”出来 ! 来美康胶原蛋白美白“逆龄”好物
冻龄颜值21天“吃”出来 ! 来美康胶原蛋白美白“逆龄”好物 源自澳洲,精准营养,优思益持续赋能全民营养健康
源自澳洲,精准营养,优思益持续赋能全民营养健康 喜讯,苏州乐珠制药荣获“2023-2024中国医药年度营销创新奖”
喜讯,苏州乐珠制药荣获“2023-2024中国医药年度营销创新奖” 优思益x成都AG超玩会,联名礼盒化作“上分神器”,传递“精准营养”
优思益x成都AG超玩会,联名礼盒化作“上分神器”,传递“精准营养” 为成都AG超玩会“上分”护航,优思益打造“精准养护”方案
为成都AG超玩会“上分”护航,优思益打造“精准养护”方案